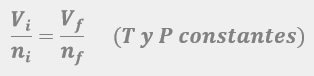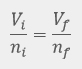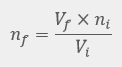Introducción
Las leyes empíricas se vinculan con las matemáticas, que describen las relaciones entre las variables de estado —presión, volumen, temperatura— en los gases; se denominan empíricas, debido a que son el resultado de observaciones y numerosos experimentos sobre distintos sistemas gaseosos.
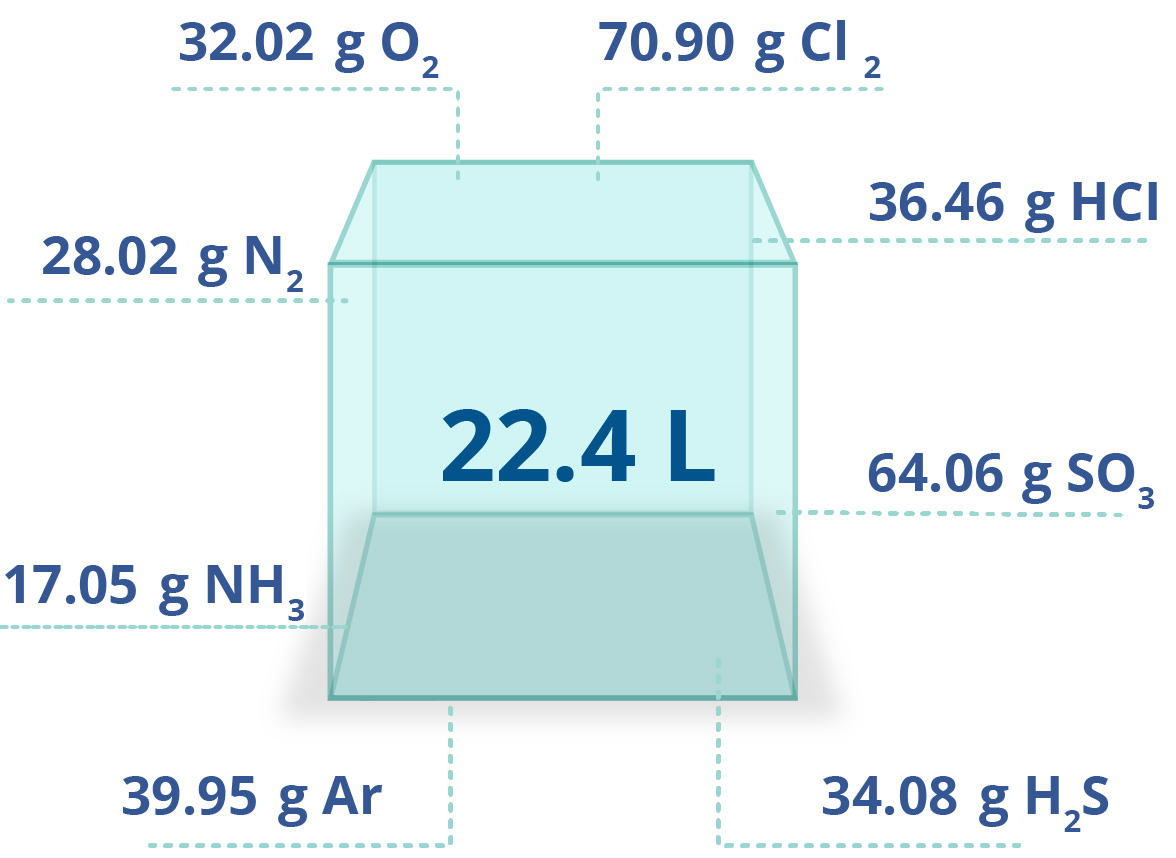
En esta unidad, cuya duración es de una hora, revisarás una de éstas, la ley de Avogadro, desde sus elementos generales hasta el proceso que se sigue cuando se aplica esta ley a un problema de impacto biológico. Un ejemplo de esta ley es cuando se inflan los globos de una fiesta y existe un aumento de los moles de aire dentro del globo, así como del volumen del mismo.

(s. a.) (2013). Globos inflados [fotografía]. Tomada de https://c.pxhere.com/photos/4a/a1/party_balloons_celebration_party_happy_birthday_balloons_happy_birthday_balloons-600810.jpg!d